(La Divina Comedia - Dante Alighieri)
Cambio Climático y Patógenos Emergentes en las ETA(s)
del siglo XXI (8ª y última parte)
Virus patógenos
Forman parte de este grupo tipos de virus muy conocidos, como los enterovirus, los astrovirus, los adenovirus entéricos, los ortorreovirus, los calicivirus y los virus de la hepatitis A y E. Los virus entéricos incluyen una amplia gama de virus, algunos de los cuales son causas importantes de morbilidad y mortalidad mundial. Los diferentes virus entéricos difieren en estructura, composición, ácido nucleico y morfología, así como en la cantidad y frecuencia de excreción, supervivencia ambiental y resistencia a los procesos de tratamiento del agua. Los virus entéricos tienen cápsides resistentes que los permiten sobrevivir en condiciones ambientales desfavorables y resistir las condiciones de acidez y de actividad proteolítica del estómago en su camino hacia el duodeno, donde infectan las células epiteliales vulnerables.
Los virus entéricos se utilizan como microorganismos indicadores o índices debido a las limitaciones de las otras opciones disponibles, ya que la capacidad de supervivencia de las bacterias fecales en medios acuáticos y su sensibilidad a los procesos de tratamiento y desinfección difieren sustancialmente de las de los virus entéricos. Por lo tanto, el monitoreo basado en uno o más representantes del gran grupo de los virus entéricos sería más útil para evaluar la presencia de cualquiera de los virus entéricos en el agua y su respuesta a las medidas de control. En todo el mundo, los virus entéricos son excretados por las personas con una frecuencia y en cantidades tales que hacen que muchos de estos virus estén presentes universalmente y en cantidades sustanciales en las aguas residuales. Sin embargo, la prevalencia de especies individuales puede variar en gran medida, debido a variaciones en las tasas de infección y excreción. Las cantidades serán mucho mayores en caso de epidemia. Aún no hay disponibles métodos prácticos para el monitoreo sistemático de un amplio espectro de virus entéricos en sistemas de abastecimiento de agua. Los virus que se detectan con más facilidad pertenecen a los grupos de los enterovirus, los adenovirus y los ortorreovirus: estos virus están presentes en cantidades relativamente altas en ambientes contaminados y se pueden detectar mediante técnicas de costo moderado y razonablemente prácticas que se basan en su efecto citopatógeno en cultivos celulares y dan resultados en 3 a 12 días (según el tipo de virus).
Se pueden hacer análisis para validar la eficacia de procesos de tratamiento y, en algunos casos, pueden formar parte de investigaciones específicas para comprobar la eficacia de los procesos. Los tiempos de incubación, el costo y la complejidad relativa de los análisis de virus entéricos hacen que no sean adecuados para el monitoreo operativo o de verificación (incluida la vigilancia). Los ortorreovirus y al menos las cepas vacunales de virus poliomielíticos que se detectan en muchos medios acuáticos, tienen también la ventaja de que no suponen un riesgo para la salud de los auxiliares de laboratorio. La presencia de cualquier virus entérico en el agua de consumo debería considerarse un índice de la posible presencia de otros virus entéricos, y es una prueba concluyente de contaminación fecal, así como de fallos en los procesos de tratamiento y desinfección del agua.
La mayoría de los virus asociados con la transmisión por el agua son los que pueden infectar el aparato digestivo y son excretados en las heces de las personas infectadas (virus entéricos). Exceptuando el virus de la hepatitis E, el ser humano se considera la única fuente de especies de virus que infectan a nuestra especie. Los virus entéricos habitualmente ocasionan enfermedades agudas con un periodo de incubación corto. El agua puede también contribuir a la transmisión de otros virus con modos de acción diferentes. Hay muy diversos tipos de virus que pueden ocasionar muy diversas infecciones y síntomas, con diferentes vías de transmisión, vías y lugares de infección y vías de excreción. Pueden darse diversas combinaciones de vías y lugares de infección, y no siempre siguen pautas previstas.
Por ejemplo, los virus que se consideran principalmente causa de infecciones y síntomas respiratorios suelen transmitirse de persona a persona en gotículas expulsadas al respirar. Sin embargo, algunos de estos virus respiratorios pueden excretarse en las heces, lo que puede ocasionar la contaminación del agua y la subsiguiente transmisión por aerosoles y gotículas. Otro ejemplo son los virus excretados en la orina, como los poliomavirus, que podrían contaminar el agua y posiblemente ser transmitidos por esa vía, con posibles efectos sobre la salud a largo plazo, como cáncer, que no se relacionan fácilmente, desde el punto de vista epidemiológico, con la transmisión por el agua.
El género Enterovirus, perteneciente a la familia Picornaviridae, comprende 69 serotipos (especies) que infectan al ser humano: los tipos 1-3 del virus de la poliomielitis, los tipos A1-A24 y B1-B6 del virus de Coxsackie, los tipos 1-33 del virus ECHO y los tipos EV69-EV73 de enterovirus numerados. Los miembros de este género se conocen colectivamente como enterovirus. Otras especies del género no infectan a las personas sino a otros animales; por ejemplo el grupo de los enterovirus bovinos. Los enterovirus están entre los virus más pequeños conocidos y constan de un genoma de ARN monocatenario rodeado por una cápside icosaédrica sin envoltura con un diámetro de 20 a 30 nm. Algunas especies del género se pueden aislar con facilidad por su efecto citopatógeno en cultivos celulares, en particular el virus de la poliomielitis, el virus de Coxsackie B, el virus ECHO y los enterovirus.
Las personas infectadas por enterovirus los excretan en las heces. De los tipos de virus detectables mediante técnicas convencionales de aislamiento en cultivo celular, los enterovirus son, por lo general, los que se encuentran en mayor abundancia en aguas residuales, recursos hídricos y aguas de consumo tratadas. Los virus se detectan también fácilmente en muchos alimentos. Se considera que las vías de transmisión predominantes de los enterovirus en las comunidades son el contacto entre personas y la inhalación de virus transportados por el aire o en gotículas respiratorias. La transmisión por el agua de consumo también podría ser importante, pero todavía no se ha confirmado. La transmisión por el agua de enterovirus (los virus de Coxsackie A16 y B5) se ha confirmado, desde el punto de vista epidemiológico, únicamente en dos brotes que se relacionaron con niños que se bañaron en aguas lacustres en la década de 1970.
Se ha comprobado la presencia de concentraciones substanciales de enterovirus en fuentes de agua bruta y en aguas de consumo tratadas. Dada su prevalencia, el agua de consumo es una fuente probable, si bien no confirmada, de infecciones por enterovirus. La escasa información sobre el papel de la transmisión por el agua puede deberse a diversos factores, como el amplio espectro de síntomas clínicos, las infecciones asintomáticas frecuentes, la diversidad de serotipos y la predominancia de la transmisión de persona a persona. Se han detectado enterovirus en aguas de consumo que cumplían las especificaciones aceptadas de tratamiento, desinfección y presencia de microorganismos indicadores convencionales. En un PSA, las medidas de control orientadas a reducir el riesgo potencial derivado de los enterovirus deben centrarse en la prevención de la contaminación del agua de alimentación por residuos humanos, y su posterior tratamiento y desinfección adecuados. Deberá validarse la eficacia de los procesos de tratamiento utilizados para eliminar los enterovirus. Las aguas de consumo deben también protegerse de la contaminación durante su distribución. El análisis de E. coli (o bien de coliformes termotolerantes) no es un índice fiable de la presencia o ausencia de enterovirus en aguas de consumo, ya que los virus son más resistentes a la desinfección.
Virus de la hepatitis A: El VHA es la única especie del género Hepatovirus de la familia Picornaviridae. Este virus comparte los rasgos morfológicos y estructurales básicos de otros grupos de la familia, como los enterovirus. El VHA del ser humano y el de los simios tienen genotipos diferentes. El VHA no se puede detectar ni cultivar con facilidad en los sistemas de cultivo celular convencionales y su detección en muestras ambientales se basa en el uso de técnicas de RPC. El VHA es muy contagioso y se considera que su dosis infectiva es baja. El virus causa la hepatitis A, también llamada «hepatitis infecciosa». Al igual que otros virus entéricos, el VHA accede, por ingestión, al aparato digestivo e infecta las células epiteliales.
Desde ahí, el virus penetra en el torrente sanguíneo y llega al hígado, donde puede dañar gravemente las células hepáticas. En hasta el 90% de los casos, sobre todo en niños, el daño hepático es escaso o nulo, la infección transcurre sin síntomas clínicos y produce inmunidad permanente. En general, la gravedad de la enfermedad aumenta con la edad. Los daños producidos a las células hepáticas ocasionan la liberación de enzimas hepáticas, como la aspartatoaminotransferasa, que se pueden detectar en el torrente sanguíneo y se utilizan como instrumento de diagnóstico. Otra consecuencia de los daños es que falla la capacidad del hígado de eliminar la bilirrubina del torrente sanguíneo; su acumulación produce los síntomas típicos de ictericia y orina oscura.
Después de un periodo de incubación relativamente largo, de unos 28 a 30 días de media, la enfermedad característicamente se manifiesta de forma repentina, con síntomas como fiebre, decaimiento, náuseas, anorexia, molestias abdominales y, finalmente, ictericia. Aunque por lo general la mortalidad es menor que el 1%, la reparación de los daños hepáticos es un proceso lento que puede mantener a los enfermos incapacitados durante seis semanas o más, con importantes consecuencias en términos de carga de morbilidad.
La mortalidad es mayor en personas de más de 50 años. El VHA está distribuido por todo el mundo, pero la prevalencia de la enfermedad clínica presenta características geográficas típicas. El VHA se excreta en la materia fecal de las personas infectadas y hay pruebas epidemiológicas sólidas de que el agua y los alimentos contaminados por heces son fuentes comunes del virus. En zonas con saneamiento deficiente los niños a menudo se infectan a una edad muy temprana y adquieren inmunidad permanente sin manifestar síntomas clínicos de la enfermedad. En zonas con un buen saneamiento la infección tiende a producirse en etapas posteriores de la vida. La vía de transmisión más común es, probablemente, de persona a persona, pero los alimentos y el agua contaminados son fuentes de infección importantes.
Las pruebas epidemiológicas de la transmisión por el agua del VHA son más concluyentes que las correspondientes a cualquier otro virus. También son relativamente frecuentes los brotes de origen alimentario, en los que los focos de infección incluyen manipuladores de alimentos infectados, marisco recolectado en aguas contaminadas y frutas y hortalizas frescas contaminadas. Las personas que viajan de zonas con buen saneamiento a zonas con saneamiento deficiente se exponen a un riesgo de infección elevado. La infección también puede transmitirse por el consumo de drogas, por vía intravenosa o por otras vías. Se ha comprobado la transmisión del VHA por aguas de consumo, y la presencia del virus en el agua de consumo constituye un riesgo importante para la salud. En un PSA, las medidas de control orientadas a reducir el riesgo potencial derivado del VHA deben centrarse en la prevención de la contaminación del agua de alimentación por residuos humanos, y su posterior tratamiento y desinfección adecuados.
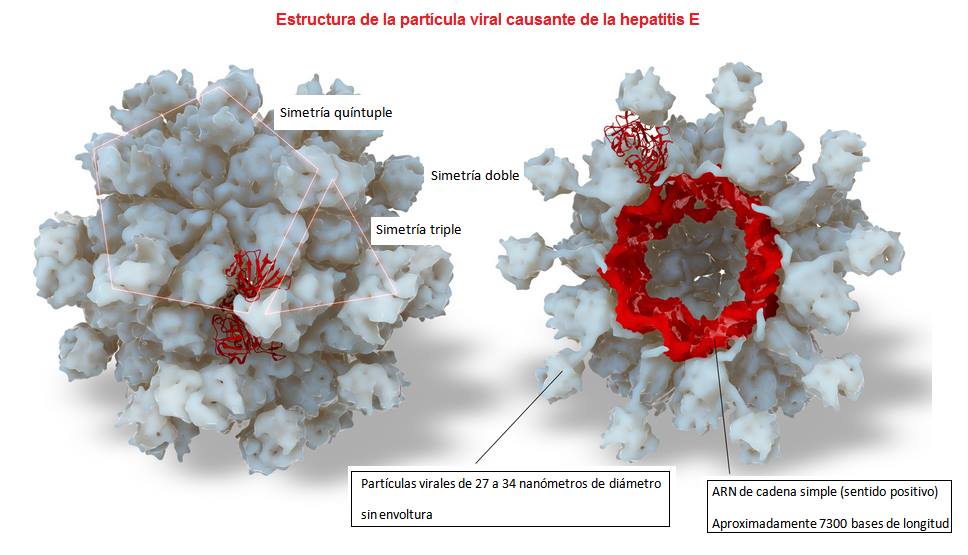
Deberá validarse la eficacia de los procesos de tratamiento utilizados para eliminar el VHA. Las aguas de consumo deben también protegerse de la contaminación durante su distribución. El análisis de E. coli (o bien de coliformes termotolerantes) no es un índice fiable de la presencia o ausencia de VHA en aguas de consumo, ya que los virus son más resistentes a la desinfección. El Virus de la hepatitis E tiene un genoma de ARN monocatenario, en una cápside icosaédrica sin envoltura de unos 27 a 34 nm de diámetro. El VHE tiene propiedades similares a muchos otros virus, por lo que es complejo clasificarlo. Durante un tiempo, el VHE se clasificó en la familia Caliciviridae, pero más recientemente se ha incluido en un grupo independiente de virus similares al de la hepatitis E. Mientras que el VHA humano consiste en un único serotipo definido claramente, hay indicios de variaciones antigénicas en el VHE, e incluso, posiblemente, diferentes serotipos del virus. El VHE no se puede detectar ni cultivar con facilidad en los sistemas de cultivo celular convencionales y su detección en muestras ambientales se basa en el uso de técnicas de RPC. El VHE causa una hepatitis que es similar en muchos aspectos a la causada por el VHA. No obstante, el periodo de incubación tiende a ser más largo (40 días de media) y las infecciones conllevan típicamente una tasa de mortalidad de hasta el 25% en mujeres embarazadas.
En las regiones endémicas, las primeras infecciones se dan típicamente en adultos jóvenes y no en niños de corta edad. A pesar de la evidencia de variación antigénica, al parecer, una infección única proporciona inmunidad permanente contra el VHE. La distribución geográfica mundial de la prevalencia es característica: el VHE es endémico y ocasiona enfermedades clínicas en ciertas partes del mundo en desarrollo, como la India, Nepal, Asia central, México y partes de África. En muchas de estas regiones el VHE es la causa principal de hepatitis vírica. Aunque la seroprevalencia puede ser elevada, los casos clínicos y brotes son poco frecuentes en otras regiones del mundo como Japón, Sudáfrica, el Reino Unido, América del Sur y del Norte, Oceanía y Europa central.
Se desconoce la razón de la escasez de casos clínicos en regiones donde hay presencia del virus. El VHE se excreta en las heces de las personas infectadas y se ha detectado en aguas residuales, tanto tratadas como sin tratar. El agua contaminada se ha asociado con grandes epidemias. La característica distintiva del VHE es que es el único virus entérico con un reservorio significativo en animales, incluidos los domésticos, en particular el ganado porcino, y también el vacuno y el caprino, e incluso en roedores. Se ha notificado la transmisión secundaria del VHE de enfermos a personas con las que han tenido contacto y, en particular, al personal de enfermería, aunque parece ser mucho menos frecuente que en el caso del VHA. La menor tasa de transmisión entre personas sugiere que el agua contaminada fecalmente podría tener un papel mucho más importante en la transmisión del VHE que en la del VHA.
Los reservorios animales también pueden servir como vías de exposición, pero todavía no se ha determinado su importancia en la infección del VHE al ser humano. Se ha confirmado que el agua contaminada puede ser fuente de VHE, y la presencia del virus en el agua de consumo constituye un riesgo importante para la salud. No hay datos analíticos sobre la resistencia del virus a los procesos de desinfección, pero los datos sobre epidemias de origen hídrico sugieren que el VHE podría ser igual de resistente que otros virus entéricos. En un PSA, las medidas de control orientadas a reducir el riesgo potencial derivado del VHE deben centrarse en la prevención de la contaminación del agua de alimentación por residuos humanos o animales, y su posterior tratamiento y desinfección adecuados. Deberá validarse la eficacia de los procesos de tratamiento utilizados para eliminar el VHE. Las aguas de consumo deben también protegerse de la contaminación durante su distribución. El análisis de E. coli (o bien de coliformes termotolerantes) no es un índice fiable de la presencia o ausencia de VHE en aguas de consumo, ya que los virus son probablemente más resistentes a la desinfección.
Parásitos patógenos
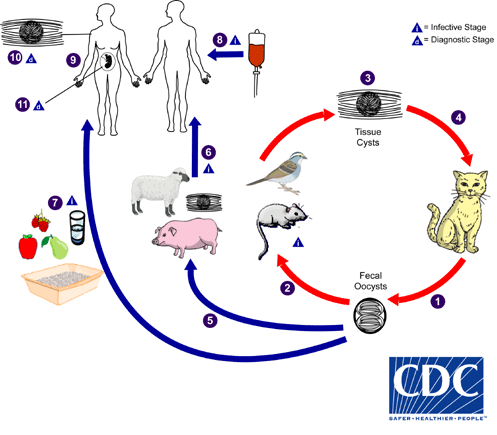
Se han descrito muchas especies de Toxoplasma y de microorganismos similares, pero parece ser que la única especie infecciosa para las personas es T. gondii. Toxoplasma gondii es un coccidio parásito, cuyo hospedador definitivo es el gato. El gato es el único animal que aloja el parásito en el tubo digestivo, donde se produce la reproducción sexual. La forma asexual que se multiplica activamente en el hospedador humano es un parásito intracelular obligado de 3 a 6 μm de diámetro llamado taquizoíto. Una fase crónica de la enfermedad se desarrolla al transformarse los taquizoítos en bradizoítos, que se reproducen lentamente y que se convierten finalmente en quistes en el tejido del hospedador.
En el ciclo natural, los quistes infecciosos se encuentran en ratones y ratas, que sirven de alimento a gatos en los que se desarrolla el estadio sexual del parásito. Tras digerirse la pared del quiste, los bradizoítos penetran en las células epiteliales del intestino delgado. Tras varias generaciones de multiplicación intracelular del parásito, se forman micro y macrogametos. La fecundación de estos últimos ocasiona el desarrollo de ooquistes que se excretan en las heces tan solo 5 días después de que un gato haya ingerido los quistes. Los ooquistes necesitan de 1 a 5 días para esporular en el medio ambiente. Tanto los ooquistes esporulados y como los tisulares pueden producir infecciones en hospedadores vulnerables. La toxoplasmosis suele ser asintomática en las personas.
En un pequeño porcentaje de casos, se presentan síntomas parecidos a los de la gripe, linfoadenopatía y hepatoesplenomegalia entre 5 y 23 días después de la ingestión de quistes u ooquistes. Los quistes latentes, formados en tejidos orgánicos tras la infección primaria, pueden reactivarse cuando se debilita el sistema inmunitario, generando una metástasis de la enfermedad a los pulmones y al sistema nervioso central, ocasionando neumonía o trastornos neurológicos graves Cuando la infección afecta a estos órganos, puede ser mortal en personas inmunodeprimidas. La toxoplasmosis congénita generalmente es asintomática, pero puede causar coriorretinitis, calcificaciones cerebrales, hidrocefalia, trombocitopenia grave y convulsiones. La primoinfección durante la etapa inicial del embarazo puede provocar un aborto espontáneo, muerte prenatal o alteraciones del desarrollo fetal.
La toxoplasmosis está presente en todo el mundo. Se calcula que en muchas partes del mundo entre el 15 y el 30% de la carne de cordero y de cerdo está infectada con quistes y que la prevalencia de gatos propagadores de ooquistes puede ser del 1%. Aproximadamente el 50% de la población europea resulta infectada antes de cumplir los treinta años, y en Francia esta proporción roza el 80%. Puede haber ooquistes de Toxoplasma gondii en fuentes de agua y sistemas de abastecimiento contaminados con heces de gatos infectados. Debido a la ausencia de métodos prácticos para la detección de ooquistes de T. gondii, hay escasa información sobre la prevalencia de los ooquistes en sistemas de abastecimiento de agua tratada y sin tratar. Tampoco se dispone de información detallada sobre la supervivencia y el comportamiento de los ooquistes en medios acuáticos.
No obstante, se han notificado pruebas cualitativas de la presencia de ooquistes en agua contaminada fecalmente y hay estudios que sugieren que los ooquistes de T. gondii pueden ser tan resistentes a las condiciones desfavorables en medios acuáticos como los de parásitos relacionados. Tanto los ooquistes de T. gondii que esporulan tras ser excretados por los gatos como los quistes tisulares son potencialmente infecciosos. Las personas pueden infectarse al ingerir ooquistes excretados por gatos, ya sea por contacto directo o por contacto con tierra o agua contaminada. Es más frecuente contraer la toxoplasmosis por el consumo de carne o productos cárnicos crudos o poco hechos que contienen quistes de T. gondii. La infección también se produce por vía transplacentaria. El agua de consumo contaminada se ha identificado como fuente de brotes de toxoplasmosis, pero se sabe poco acerca de la respuesta de T. gondii a los procesos de tratamiento del agua. Los ooquistes de este microorganismo son más grandes que los de Cryptosporidium y deberían poderse eliminar mediante filtración.
En un PSA, las medidas de control orientadas a reducir el riesgo potencial derivado de T. gondii deben centrarse en la prevención de la contaminación del agua de alimentación por gatos salvajes y domésticos. En caso necesario, los microorganismos pueden eliminarse mediante la filtración. Dada la falta de información sobre la sensibilidad de T. gondii a la desinfección, se desconoce la fiabilidad del análisis de E. coli (o bien de coliformes termotolerantes) como índice de la presencia o ausencia de estos microorganismos en aguas de consumo. En cuanto a los potenciales Helmintos patógenos, recordamos primero que el término «helminto» procede de la palabra griega que significa «gusano» y hace referencia a todos los tipos de gusanos, tanto los parasitarios como los no parasitarios. Los principales gusanos parásitos se clasifican fundamentalmente en el filo Nematoda (nematodos) y el filo Platyhelminthes (platelmintos, incluidos los trematodos). Los helmintos parásitos infectan a numerosas personas y animales en todo el mundo.
El agua de consumo no es una vía de transmisión significativa de la mayoría de los helmintos, pero hay dos excepciones: Dracunculus medinensis (dracúnculo) y Fasciola spp. (F. hepatica y F. gigantica) (trematodos hepáticos). Ambos nematodos necesitan hospedadores intermedios para completar sus ciclos biológicos, pero se transmiten por el agua de consumo mediante mecanismos diferentes. Otras helmintiasis pueden transmitirse por contacto con el agua (esquistosomiasis) o están asociadas al uso agrícola de aguas residuales sin tratar (ascariasis, tricuriasis, anquilostomiasis y estrongiloidiasis), pero no suelen transmitirse por el agua de consumo. Fasciola spp, produce fascioliasis con dos especies de trematodos del género: F. hepatica, presente en Europa, África, Asia, América y Oceanía, y F. gigantica, que se encuentra principalmente en África y Asia. La fascioliasis humana se consideró una enfermedad zoonótica secundaria hasta mediados de la década de 1990. En la mayoría de las regiones, la fascioliasis se transmite por los alimentos. Sin embargo, el descubrimiento de metacercarias flotantes en regiones hiperendémicas (como en la región del altiplano andino en Sudamérica) indica que el agua de consumo puede ser una vía de transmisión significativa de la fascioliasis en ciertos lugares.
El ciclo biológico de F. hepatica y F. gigantica dura entre 14 y 23 semanas y necesita dos hospedadores. Se compone de cuatro fases. En la primera fase, el hospedador definitivo ingiere las metacercarias; éstas se exquistan en el tubo digestivo y después migran al hígado y las vías biliares. Transcurridos de 3 a 4 meses, los trematodos alcanzan la madurez sexual y producen huevos, que se excretan a la bilis y el intestino. Los trematodos adultos pueden vivir entre 9 y 14 años en el hospedador. En la segunda fase, la persona o animal excreta los huevos; cuando alcanzan agua dulce, se desarrolla un miracidio en el interior. En la tercera fase, los miracidios penetran en un caracol hospedador y se desarrollan en cercarias, que se liberan en el agua. En la cuarta y última fase, las cercarias nadan durante un breve periodo hasta que alcanzan un lugar adecuado al que fijarse (plantas acuáticas), donde se enquistan y forman metacercarias que se convierten en infecciosas en 24 horas. Algunas metacercarias no se adhieren a las plantas, sino que permanecen flotando en el agua. Los parásitos se alojan en los conductos biliares grandes y en la vesícula biliar. La enfermedad presenta síntomas distintos en las fases aguda y crónica de la infección. La fase invasiva o aguda puede durar de 2 a 4 meses y se caracteriza por síntomas como dispepsia, náuseas y vómitos, dolor abdominal y fiebre alta (hasta 40 °C). También se pueden producir anemia y respuestas alérgicas (por ejemplo, prurito y urticaria).
En niños, la infección aguda puede ocasionar síntomas graves y, en ocasiones, causar la muerte. La fase obstructiva o crónica (tras meses o años de infección) puede caracterizarse por una hepatomegalia dolorosa y, en ciertos casos, ictericia obstructiva, dolores torácicos, pérdida de peso y colelitiasis. Las secuelas más importantes de la enfermedad son lesiones hepáticas, fibrosis e inflamación crónica de las vías biliares. Los trematodos inmaduros pueden desviarse durante su migración, penetrar en otros órganos y ocasionar fascioliasis ectópica en diversos tejidos subcutáneos. La fascioliasis se puede tratar con triclabendazol. Los casos en personas han ido en aumento en 51 países de cinco continentes. Las estimaciones del número de personas con fascioliasis oscilan entre 2,4 y 17 millones, o incluso más, en función de cuál sea la prevalencia, no cuantificada, en muchos países de África y Asia.
El análisis de la distribución geográfica de los casos en personas muestra que la correlación entre la fascioliasis animal y humana sólo se produce a un nivel básico. Las zonas con tasas de prevalencia altas en personas no se corresponden necesariamente con zonas donde la fascioliasis es un gran problema veterinario. Hay problemas de salud graves asociados a la fascioliasis en países andinos (Bolivia, Perú, Chile, Ecuador), el Caribe (Cuba), el norte de África (Egipto), Oriente Próximo (Irán y países vecinos) y Europa occidental (Portugal, Francia y España). Las personas pueden contraer fascioliasis cuando ingieren metacercarias infecciosas al comer plantas acuáticas crudas (y, en algunos casos, plantas terrestres, como lechuga, regadas con agua contaminada), beber agua contaminada, emplear utensilios lavados con agua contaminada o comer hígado crudo infectado con trematodos inmaduros. Con frecuencia, se cita al agua como fuente de infección para las personas.
En el altiplano boliviano, el 13% de las metacercarias aisladas son flotantes. El agua de consumo sin tratar en regiones hiperendémicas suele contener metacercarias flotantes; por ejemplo, en un pequeño arroyo que atraviesa la región del altiplano boliviano se detectaron hasta 7 metacercarias por cada 500 ml. Existen pruebas indirectas que sustentan la importancia del agua como vía de transmisión de la fascioliasis. Se han establecido asociaciones positivas significativas entre la infección por trematodos hepáticos y la infección por otros protozoos y helmintos transmitidos por el agua en países andinos y en Egipto. En muchas zonas de América hiperendémicas de fascioliasis humana, no es costumbre consumir berros ni otras plantas acuáticas. En la región del Delta del Nilo, el riesgo de infección de las personas que vivían en casas con acceso a agua entubada era más alto. Es probable que las metacercarias sean resistentes a la desinfección con cloro, pero probablemente puedan eliminarse mediante diversos procesos de filtración. Por ejemplo, en Tiba (Egipto) la prevalencia en personas disminuyó drásticamente después de que se suministrara agua filtrada a lavaderos con un diseño especial.
Marea Roja
En Chile y Argentina, se presentan tres tipos de toxinas marinas, la toxina paralizante, la diarreica y la amnésica, conocidas mundialmente como PSP (Paralitic Shellfish Poison), DSP (Diarreic Shellfish Poison) y ASP (Amnesic Shellfish Poison) por sus siglas en inglés. La intoxicación por estas toxinas es por vía digestiva, es decir, por la ingestión de moluscos contaminados (Sin importar que estos estén o no cocidos) y se presenta de forma aguda, sin embargo, en el caso de la DSP se postula que estas toxinas además pueden ser promotores de tumores por lo que acarrearían efectos crónicos, y en el caso de la toxina amnésica, como su nombre lo indica, en intoxicaciones graves puede producir amnesia irreversible.
La intoxicación por mariscos se presenta en productos de mar con dos caparazones tales como las almejas, las ostras, los mejillones y algunas veces las vieiras (ostiones). Las sustancias dañinas que causan la intoxicación por ciguatera, escombroides y mariscos son termoestables, de tal manera que ningún grado de cocción lo protegerá de resultar intoxicado si consume pescado contaminado. Los síntomas dependen del tipo específico de intoxicación. El envenenamiento a través de los mariscos es causado por un grupo de toxinas producidas por las algas tipo plancton (en la mayoría de los casos las dinoflageladas) que constituyen el alimento principal de los mariscos. Posteriormente, estas toxinas son acumuladas y algunas veces metabolizadas en su interior. Los 20 tipos de toxinas responsables del envenenamiento por mariscos causante de parálisis (PSP,por sus siglas en inglés) son derivadas de la saxitoxina. Por otro lado, el envenenamiento por mariscos diarreico (DSP, por sus siglas en inglés) es causado presumiblemente por un grupo de poliéteres de alto peso molecular, incluyendo el ácido okadaico, las toxinas de la dinófisis, las pectenotoxinas y la yesotoxina. El envenenamiento por mariscos neurotóxico (NSP, por sus siglas en inglés) es el resultado de la exposición del cuerpo a un grupo de poliéteres llamados brevetoxinas.
Finalmente, el envenenamiento por mariscos amnésico (ASP, por sus siglas en inglés) es causado por un aminoácido inusual llamado ácido domoico, que es un contaminante. En la Intoxicación paralítica por mariscos, aproximadamente 30 minutos después de haber consumido productos de mar contaminados, se puede presentar entumecimiento u hormigueo en la boca, una sensación que se puede extender a los brazos y las piernas. Puede haber mareos, dolor de cabeza y en algunos casos los brazos y las piernas pueden llegar paralizarse temporalmente. Algunas personas también pueden presentar náuseas, vómitos y diarreas, aunque estos síntomas son mucho menos frecuentes. Por su parte, la Intoxicación neurotóxica por mariscos, presenta síntomas muy similares a la intoxicación por ciguatera. Después de comer almejas o mejillones contaminados, se experimentan náuseas, vómitos y diarrea. Estos síntomas son seguidos por: entumecimiento u hormigueo en la boca, dolor de cabeza, mareo, así como trastrocamiento de las temperaturas caliente y fría. Finalmente, en la Intoxicación amnésica por mariscos, vemos una forma de intoxicación extraña y poco común que comienza con náuseas, vómitos y diarrea, seguida de una pérdida de la memoria por un período corto, al igual que otros síntomas neurológicos menos frecuentes. Debido a que, como dijimos, estos tóxicos son termoestables, no hay una forma para que la persona que prepara el alimento sepa que éste está contaminado, se debe asegurar que los proveedores del pescado contaminado sean identificados y que todo el pescado de ese mismo lote, que posiblemente esté contaminado, sea destruido.
La ingestión de mariscos contaminados resulta en una amplia variedad de síntomas, los que dependerán del tipo de toxina(s) presente(s), la concentración en la que se halla y la cantidad de marisco contaminado que es ingerido. En el caso de la PSP los efectos son predominantemente neurológicos e incluyen la sensación de hormigueo, sofocación, entumecimiento, somnolencia, incoherencia al hablar y parálisis respiratoria. Por otro lado, los síntomas asociados con la DSP, NSP y la ASP son menos característicos. La DSP es detectada principalmente como un desorden gastrointestinal generalmente suave, que incluye síntomas tales como náuseas, diarrea, vómitos y dolores abdominales acompañados de escalofríos, dolor de cabeza y fiebre. Tanto los síntomas gastrointestinales como los neurológicos son característicos de la NSP, e involucran la sensación de hormigueo y el entumecimiento de los labios, la lengua y la garganta. Además también se pueden presentar dolores musculares, vértigo, inversión de las sensaciones de frío y calor, diarrea y vómito. Finalmente, la ASP es caracterizada por desórdenes gastrointestinales (vómitos, diarrea, dolores abdominales) y problemas neurológicos (confusión, pérdida de memoria, desorientación, ataques epilépticos o el coma).
Los síntomas de la enfermedad PSP se presentan rápidamente dentro de las 2 horas posteriores al consumo del marisco, lo que dependerá de la cantidad de toxina ingerida. En los casos severos es común que se presente una parálisis respiratoria, pudiendo sobrevenir la muerte de no proveerse la ayuda necesaria. Cuando ésta es aplicada dentro de las primeras 12 horas de exposición, usualmente la recuperación es completa sin dejar efectos colaterales. En ciertos casos inusuales y debido a la débil acción hipotensora de la toxina, puede ocurrir la muerte por un colapso cardiovascular a pesar de que se haya proveído de la ayuda para la respiración. En la NSP, la sintomatología aparece a los pocos minutos u horas, siendo su duración relativamente corta (desde unas pocas horas hasta varios días). La recuperación es completa aunque puede dejar algunos efectos posteriores.
No se ha reportado ningún caso fatal. Por último, en la DSP y dependiendo de la dosis de toxina ingerida, los síntomas pueden presentarse rápidamente (ej. a los 30 minutos) ó a las 2 a 3 horas posteriores al consumo del alimento y pueden durar aproximadamente de 2 a 3 días. La recuperación es completa sin dejar efectos posteriores, y por lo general esta enfermedad no es fatal.
El diagnóstico del envenenamiento a través de mariscos se basa completamente en la sintomatología. Todos los mariscos (incluyendo los moluscos que se alimentan usando el sistema de filtración) son potencialmente tóxicos. Sin embargo, la PSP es asociada generalmente con los mejillones, las almejas, los berberechos y las veneras encontradas especialmente, aunque no solamente, en el Océano Pacífico. Por otro lado, la NSP está asociada principalmente con los mariscos obtenidos de la costa de Florida y del Golfo de México; la DSP con los mejillones y la ASP con los mejillones solamente. La única forma de que el envenenamiento por estas toxinas puede ser evitado es no consumiendo los mariscos. No obstante, las autoridades saben frecuentemente cuando las algas han aflorado localmente, prohibiéndose la pesca de mariscos. Así mismo, y especialmente en el caso de la DSP, los mariscos son mantenidos en agua limpia por un período de tiempo determinado antes de proceder a su venta y consumo.
En la mayoría de los países los mariscos son monitoreados para encontrar alguna de las diferentes toxinas, y la mayoría de los casos que se han presentado son atribuidos a aquellos mariscos obtenidos por personas ajenas a la localidad o turistas. Un número desproporcionado de casos PSP (especialmente en los EEUU donde este tipo de enfermedad es relativamente común) se presenta entre los turistas u otras personas que no son nativas del área en la que los mariscos contaminados son obtenidos. Esto puede presentarse a pesar de las cuarentenas oficiales establecidas o las tradiciones de consumo seguras, técnicas dirigidas a proteger la salud de la población local. Todos los seres humanos somos susceptibles al envenenamiento por mariscos, y especialmente los ancianos parecen estar predispuestos a los efectos neurológicos severos causados por la toxina de los mariscos.
Los dinoflagelados forman parte de gran y diverso grupo de organismos microscópicos, y normalmente unicelulares, que se clasifican como protistas (organismos celulares que no se pueden clasificar estrictamente como hongos, plantas, o animales). Generalmente tienen dos extensiones en forma de látigo (los flagelos) de diferentes tamaños, las cuales usan para la locomoción y causan la característica trayectoria natatoria en espiral. Algunos dinoflagelados son fotosintéticos y de vida libre, otros son autotróficos y/o simbióticos con protozoos y animales marinos, algunos son depredadores, y algunos son parasíticos. Grandes floraciones de dinoflagelados a veces imparten un color rojizo a las aguas y crean las conocidas "mareas rojas". Existen diferentes formas de toxinas producidas por los dinoflagelados, y estas pueden variar dependiendo en la especie y en la ubicación geográfica. Algunas, tales como las maiotoxinas son excretadas, y causan problemas solo si se consumen los intestinos de peces infectados. Por el contrario, las ciguatoxinas, tienden a acumularse en varios tejidos incluyendo los de músculos y órganos internos. Las ciguatoxinas son extremadamente potentes y son resistentes al frío y calor, por lo cual cocinar o congelar los peces o mariscos no las destruyen. Existen pruebas para detectar ciguatera en los peces y mariscos, siendo la más común el bioensayo de ratón, pero los procedimientos son complicados y puede tomar más de cuatro días para obtener resultados.
Características y Efectos de las Toxinas en Mariscos
Toxina Paralizante de los moluscos
Toxina Diarreica de los moluscos
Toxina Amnésica de los moluscos
Sigla
PSP
DSP
ASP
Ruta de Acceso
Ingestión
Ingestión
Ingestión
Período de Incubación
5 a 30 minutos.
Menos de 24 horas
Días a años (Según concentración
ingerida)
Duración de los Efectos
Días
Días
Días
Sintomatología
Aguda
Sensación de hormigueo en labios.
Adormecimiento de cara y extremidades que luego se propaga al resto del cuerpo.
Sensación de liviandad, dificultad para hablar y tragar.
Paro respiratorio.
Muerte
Dolor abdominal, náuseas, vómito y diarrea.
Náuseas, vómito, diarrea, dolor abdominal.
Dolor de cabeza, pérdida de concentración.
Pérdida de equilibrio, visión borrosa, confusión.
Pérdida de memoria.
Coma.
Muerte
Sintomatología Crónica
Desconocida
Cancerígenos
Amnesia
Terapia
Medidas de soporte (Respirador artificial)
Medidas de soporte
Medidas de soporte
Miscelánea final: Histórico acuerdo en París para frenar el calentamiento global
Lo aprobaron 195 países. Reducirán los niveles de contaminación para que la temperatura del planeta no suba más de 2° de aquí al fin del siglo. Intentarán así evitar catástrofes ambientales y más daños al ecosistema. La era de los combustibles fósiles empezó hoy su tiempo de descuento, cuando en París se aprobó por unanimidad un acuerdo histórico para limitar la suba de la temperatura global a “muy por debajo” de los 2° centígrados respecto de los niveles existentes en la era preindustrial, un aumento causado por la acumulación sostenida de dióxido de carbono en la atmósfera. Esta es una meta difícil, que requerirá de un esfuerzo de países grandes y chicos, siempre tratando de elevar su volumen de ambición, como dice el texto que emergió de la Cumbre del Clima, tras dos semanas de maratónicas negociaciones.
Este fue un triunfo rotundo de la sociedad civil, que viene presionando en las negociaciones y las calles por una agenda en la que la gente esté por encima de los lobbistas, lo que tomó más de 20 años de combatir mentiras maliciosas sobre la realidad del cambio climático. Y, obviamente, también de la diplomacia de Francia, que ha logrado con inteligente persistencia tender puentes donde no los había, doblar brazos. Hasta al canciller Laurent Fabius, que condujo estas negociaciones, se le caían las lágrimas al anunciar el texto, un momento en el que la emoción cortaba el aire. Ya los científicos dijeron que este acuerdo no era suficiente, pero desde las ONGs apuntan que es un muy buen comienzo. Es un tratado vinculante y su objetivo principal es mantener la temperatura “muy por debajo de los 2 grados de aumento respecto de la era preindustrial y proseguir los esfuerzos para limitar ese aumento de la temperatura a 1,5 grados”. Como la arquitectura de este proceso está organizada de abajo hacia arriba, desde el esfuerzo de cada país, y no desde la imposición de un órgano centralizado, cada parte deberá superar la ambición de sus metas cada 5 años, algunos empezando en 2020, cuando entra en vigor el acuerdo. En 2018, se realizará “un diálogo para hacer un balance de los esfuerzos colectivos “ y el IPCC, el órgano que produce la ciencia de cambio climático, ha de realizar un informe especial sobre qué significa un aumento de 1,5 grados.
Casi todos los países –a excepción de Venezuela, Nicaragua y otros pocos más– han presentado planes de mitigación del cambio climático pero la suma de todos esos esfuerzos –reconoce el texto final aprobado– sigue agregándole a la atmósfera 55 gigatoneladas de dióxido de carbono, lo que tardará siglos y siglos desaparecer de allí, atrapando el calor del sol (Una gigatonelada equivale a un millón de millones, la cifra seguida de doce ceros). Para limitar la suba a 2 grados, no se debería agregar más de 40 gigatoneladas de gases de efecto invernadero. Por lo tanto, la periodicidad, la revisión y la transparencia de los nuevos planes es absolutamente crucial. El acuerdo contiene un artículo dedicado a los daños y pérdidas causados por el cambio climático, un reclamo de los países vulnerables. Sin embargo, no es su costado más ambicioso. Y por expreso pedido de los Estados Unidos, teniendo en cuenta que su Congreso está repleto de campeones del negacionismo, el texto dice explícitamente que “no implica ni da lugar a ninguna forma de responsabilidad jurídica o indemnización “ por parte de las víctimas del cambio climático.
Otro aspecto clave es la llamada “diferenciación”. Esto es que cada país hace su recambio tecnológico a la medida de sus posibilidades. Pero aquí el texto tiene un mecanismo del presión: que es el de lo que dice la ciencia. Indica textualmente que es necesario “lograr que las emisiones mundiales de gases de efecto invernadero alcancen su punto máximo lo antes posible, teniendo presente que los países en desarrollo tardarán más en lograrlo y a partir de ese momento reducir rápidamente las emisiones de gases de efecto invernadero de conformidad con la mejor información científica posible para alcanzar un equilibrio entre emisiones antropogénicas y las fuentes y la absorción antropogénicas por los sumideros en la segunda mitad del siglo”. Todo esto es un lenguaje enredado. Hubiera sido mejor que pidiera la descarbonización total de las economías al 2050, que era la ambición de la mayoría de las ONGs. Pero este es un acuerdo entre 195 países, cada uno con cabeza distinta. Como decía ayer Oscar Soria, un brillante argentino de la organización Avaaz, este acuerdo “es un mecanismo” para llegar a la meta de 100 por ciento de energías renovables. “Los cambios no son lineales, son progresivos. Este acuerdo nos lleva a seguir cambiando cosas”, sostuvo. Ahora, las palabras deberán estar coronadas por la acción.
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HABITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.

















.jpg)